Konstanta disosiasi asam
|
Read other articles:

この項目では広島県の北広島町について説明しています。北海道の「北広島市」とは異なります。 画像提供依頼:鳴滝の画像提供をお願いします。(2021年10月) きたひろしまちょう 北広島町 壬生の花田植(無形文化遺産) 北広島町旗2005年10月20日制定 北広島町章2005年10月20日制定 国 日本地方 中国地方、山陽地方中国・四国地方都道府県 広島県郡 山県郡市町村コー…

Эта статья — о Московской губернии,. Об административно-территориальной единице России, существующей по сей день см. Московская область.Губерния Российской империиМосковская губерния Герб 55°45′06″ с. ш. 37°37′04″ в. д.HGЯO Страна Российская империя Ад…

American Founding Father, orator and politician For other uses, see Patrick Henry (disambiguation). For the 21st-century North Carolina legislator, see Patrick McHenry. Patrick Henry1st and 6th Governor of VirginiaIn officeDecember 1, 1784 – December 1, 1786Preceded byBenjamin Harrison VSucceeded byEdmund RandolphIn officeJuly 5, 1776 – June 1, 1779Preceded byEdmund Pendleton (acting)Succeeded byThomas JeffersonMember of theVirginia House of DelegatesConstituencyHenry Count…

Twittpic Comparte fotos y videos en Twitter Información generalDominio http://www.twitpic.comTipo Compartir imágenesRegistro NecesarioIdiomas disponibles InglésEn español NoEstado actual Modo sólo lecturaGestiónDesarrollador Noah EverettPropietario Noah EverettLanzamiento Principios del 2008EstadísticasRanking Alexa 48841 (2017)[editar datos en Wikidata] Twitpic fue un sitio web que permitía a los usuarios publicar fácilmente fotos en Twitter, microblogging y redes social…
Історія освоєння мінеральних ресурсів Чилі До періоду іспанського завоювання (30-і рр. XVI ст.) індіанці Чилі були знайомі з обробкою металів, виготовляли зброю, срібні прикраси. З кінця XV ст. інками розроблялися багаті мідні рудники «Чукікамата» на півночі країни. У перші

Contents January - February - March - April - May - June - July - August - September - October - November - December ← 1983 1984 1985 → The following is a list of notable deaths in 1984. Entries for each day are listed alphabetically by surname. A typical entry lists information in the following sequence: Name, age, country of citizenship at birth, subsequent country of citizenship (if applicable), reason for notability, cause of death (if known), and reference. Deaths in 1984 January Alfred…

American college football season 1888 Michigan Wolverines footballConferenceIndependentRecord2–1Head coachNoneCaptainJames E. DuffyHome stadiumAnn Arbor FairgroundsSeasons← 18871889 → 1888 Midwestern college football independents records vte Conf Overall Team W L T W L T Cincinnati – 1 – 0 – 1 Notre Dame – 1 – 0 – 0 Washington University – 1 – 0 …

Jenderal Besar Angkatan Darat Britania RayaTanda pangkat bahu Jenderal BesarNegara Britania RayaCabang angkatan Angkatan Darat Britania RayaSingkatanFMPangkatPangkat bintang limaPangkat NATOOF-10Pangkat non-NATOO-11Pembentukan1736Pangkat bawahanJenderalPangkat setaraLaksamana Besar (RN)Marsekal Angkatan Udara Britania Raya (RAF) Jenderal Besar telah menjadi pangkat tertinggi di Angkatan Darat Britania Raya sejak 1736. Pangkat bintang lima dengan kode NATO OF-10 ini, setara dengan Laksa…

كاسيني-هويجنز المشغل ناسا، ووكالة الفضاء الأوروبية، ووكالة الفضاء الإيطالية سمي باسم جيوفاني دومينيكو كاسيني، وكريستيان هوغنس تاريخ الإطلاق 15 أكتوبر 1997[1] نقطة النهاية زحل الموقع الإلكتروني الموقع الرسمي تعديل مصدري - تعديل كاسيني-هوي…

التصنيف الرئيسي | اقتصاد | جغرافيا | سياسة | تاريخ | رياضة | عدل بوابة جنوب السودان علم جنوب السودان شعار جمهوية جنوب السودان جمهورية جنوب السودان هي دولة تقع في شرق أفريقيا، وتعتبر مدينة جوبا عاصمتها وأكبر مدنها، ومن أكبر مدنها هي واو وملكال ورومبيك وأويل وياي. وتجدر الإ…

Paste made from peppers or tomato and salt, originating in Turkey This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: Salça – news · newspapers · books · scholar · JSTOR (June 2023) (Learn how and when to remove this template message) SalçaBiber salçası (pepper paste)TypePaste, spreadMain ingredientsChili peppe…

Biogeographic region of Southeast Asia Not to be confused with Sunderland. Sundas redirects here. For the Greater Sundas, see Greater Sunda Islands. For the Lesser Sundas, see Lesser Sunda Islands. For the continental shelf of Southeast Asia, see Sunda Shelf. The Sahul Shelf and the Sunda Shelf today. The area in between is called Wallacea Sundaland[1] (also called Sundaica or the Sundaic region) is a biogeographical region of South-eastern Asia corresponding to a larger landmass that wa…

Map of arrondissements of the Drôme department. The 3 arrondissements of the Drôme department are:[1] Arrondissement of Die, (subprefecture: Die) with 113 communes. The population of the arrondissement was 67,063 in 2016. Arrondissement of Nyons, (subprefecture: Nyons) with 149 communes. The population of the arrondissement was 148,049 in 2016. Arrondissement of Valence, (prefecture of the Drôme department: Valence) with 102 communes.[2] The population of the arrondissement wa…

ADO Den HaagNama lengkapIng.: Haagsche Football Club Bld.: Alles Door Oefenen Den HaagNama singkatADO Den HaagBerdiri1 Februari 1905StadionStadion Cars Jeans(Kapasitas: 15.000)KetuaHenk JagersmaManajerHenk FräserLigaEredivisie2013–14ke-9, Eredivisie Kostum kandang Kostum tandang Kostum ketiga Musim ini ADO Den Haag [ˈaː.do dɛn ˈɦaːχ] (nama lengkap: Alles Door Oefenen Den Haag (pengucapan bahasa Belanda: [ˈɑ.ləs doːr ˈu.fə.nɪŋ dɛn ˈɦaːχ])) merupakan sebuah tim sepak bo…

Éric VignerÉric Vigner in 2015.BornOctober 27, 1960Rennes, FranceNationalityFrenchEducationENSATT, CNSAD, ParisKnown forStage director, Scenic designer, Theater directorNotable workFrance, Russia, South Korea, Albania, United States, Romania, Canada, IndiaAwardsNomination Molière Awards 1996, French-Corean Cultural Prize 2004ElectedOfficier de l'Ordre des Arts et des Lettres Éric Vigner (born October 27, 1960, in Rennes, France) is a French stage director, actor and scenic designer. He …

Boxing competitions Women's middleweight boxingat the Games of the XXXI OlympiadVenueRiocentro – Pavilion 6Date14–21 August 2016Competitors12 from 12 nationsMedalists Claressa Shields United States Nouchka Fontijn Netherlands Dariga Shakimova Kazakhstan Li Qian China← 20122020 → Boxing at the2016 Summer OlympicsQualificationMenWomen49 kg51 kg52 kg60 kg56 kg75 kg60 kg64 kg69 kg75 kg81 kg91 kg+91 kgvte The women's middleweight boxing comp…

English temperance movement activist Portrait of Miss Caine (4674326) Ruth, Lady Herbert Lewis, OBE (née Caine; 29 November 1871 – 26 August 1946) was an English temperance movement activist of Manx descent and collector of Welsh folk songs. She published collections of Welsh folk songs, and was a key member of the Welsh Folk-Song Society in the first half of the 20th century. Early life and education Ruth Caine was born in Liverpool, the daughter of William Sproston Caine and Alice Brown Cai…

Esta página cita fontes, mas que não cobrem todo o conteúdo. Ajude a inserir referências. Conteúdo não verificável pode ser removido.—Encontre fontes: ABW • CAPES • Google (N • L • A) (Fevereiro de 2019) Clotilde Clotilde de França Rainha Consorte da Sardenha Reinado 16 de outubro de 1796a 7 de março de 1802 Predecessora Maria Antônia de Bourbon Sucessora Maria Teresa da Áustria-Este Nascimento 23 de setembro de …

American novelist The foreman of the J.A.6, cover Edith Hancock Johnson (February 9, 1876 – June 1, 1946), who wrote under the pen-name of E. Joy Johnson, was an American novelist of the early 20th century.[1][2] Early life Edith Hancock Johnson was born at New Tredegar, South Wales, on February 9, 1876, to the reverend Joseph J. Hancock and Elizabeth Hamlin.[1][2][3] The family moved to New York State when Johnson was six years old.[2] Johnson t…

Indian ascetic and environmentalist This article is an orphan, as no other articles link to it. Please introduce links to this page from related articles; try the Find link tool for suggestions. (March 2023) Akhileshwaranand GiriCabinet Minister, Madhya Pradesh GovernmentIn officeJune 2018 – IncumbentMinister of State, Madhya Pradesh GovernmentIn officeApril 2018 – Incumbent Personal detailsProfessionSpiritual Leader, Preacher Mahamandaleshwar Swami Akhileshwaranand Giri is…


![{\displaystyle K_{\text{a}}=\mathrm {\frac {[A^{-}][H^{+}]}{[HA]}} ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7cdd9efda0e3a32060020b5c9e5b2c78981b2a93)
![{\displaystyle \mathrm {p} K_{{\ce {a}}}=-\log _{10}K_{\text{a}}=\log _{10}{\frac {{\ce {[HA]}}}{[{\ce {A^-}}][{\ce {H+}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d7af05bf129db2f9bc618fe809660b6e4ff8dce9)


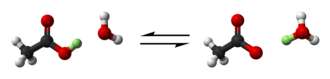





![{\displaystyle {\ce {[Al(H2O)6]^3+ + H2O <=> [Al(H2O)5(OH)]^2+ + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b1c60923d504a87f8bbd22293ac8eaad8341ea41)



![{\displaystyle K^{\ominus }={{\frac {[{\ce {A^-}}][{\ce {H+}}]}{{\ce {[HA]}}}}\Gamma },\quad \Gamma ={\frac {\gamma _{{\ce {A^-}}}\ \gamma _{{\ce {H+}}}}{\gamma _{{\ce {HA}}}\ }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e9373db7091aeb4f51a26757a677b420f0a8418)
![{\displaystyle [{\text{HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3cfe8305c0735d25de8cef20edf09ef5144d700a)


![{\displaystyle {\begin{aligned}K_{\text{b}}&=\mathrm {\frac {[HB^{+}][OH^{-}]}{[B]}} \\\mathrm {p} K_{\text{b}}&=-\log _{10}\left(K_{\text{b}}\right)\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5dea1aac629a595476e18c042a8f4365a50f0efc)
![{\displaystyle \mathrm {[OH^{-}]} ={\frac {K_{\mathrm {w} }}{\mathrm {[H^{+}]} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab7f583da9f8b50145990ffa4342919930edfa16)
![{\displaystyle K_{\text{b}}={\frac {[\mathrm {HB^{+}} ]K_{\text{w}}}{\mathrm {[B][H^{+}]} }}={\frac {K_{\text{w}}}{K_{\text{a}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/921c3abd37a1c5c00c31831509d3b090394c0d47)



