| Kristallstruktur
|
|
| _ Cs+ 0 _ OH−
|
| Kristallsystem
|
orthorhombisch
|
| Raumgruppe
|
Cmcm (Nr. 63)Vorlage:Raumgruppe/63
|
| Gitterparameter
|
a = 4,35 Å, b = 11,99 Å und c = 4,516 Å
|
| Allgemeines
|
| Name
|
Caesiumhydroxid
|
| Verhältnisformel
|
CsOH
|
| Kurzbeschreibung
|
weiße bis gelbe hygroskopische Kristalle[1]
|
| Externe Identifikatoren/Datenbanken
|
|
|
| Eigenschaften
|
| Molare Masse
|
149,92 g·mol−1
|
| Aggregatzustand
|
fest
|
| Dichte
|
3,68 g·cm−3[1]
|
| Schmelzpunkt
|
272,3 °C[1]
|
| Löslichkeit
|
sehr leicht in Wasser (3000 g·l−1 bei 30 °C)[2]
|
| Sicherheitshinweise
|
|
|
| MAK
|
Schweiz: 2 mg·m−3 (gemessen als einatembarer Staub)[3]
|
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa).
|
Caesiumhydroxid, CsOH, ist das Hydroxid des Caesiums. Es ist in wässriger Lösung eine der stärksten Basen.
Gewinnung und Darstellung
Caesiumhydroxid entsteht neben Wasserstoff bei der äußerst heftigen Reaktion (Explosionsgefahr) von Wasser mit Caesium:

Eine weitere Synthesemöglichkeit ist durch die Reaktion von Caesiumoxid mit Wasser gegeben.

Während der Vermischung können heftige Reaktionen auftreten.
Analog zum Rubidiumhydroxid ist auch das Caesiumhydroxid über das Sulfat zugänglich:

Das entstehende Bariumsulfat fällt quantitativ aus und die Caesiumhydroxidlösung kann nach der Filtration vorsichtig zunächst über Kaliumhydroxid in einer Platin-Schale eingeengt werden, bis sich das Salz abscheidet. Dieses wird schließlich in einem Silber-Schiffchen im trockenen Wasserstoff-Strom langsam auf 300 °C erhitzt.[4]
Eigenschaften
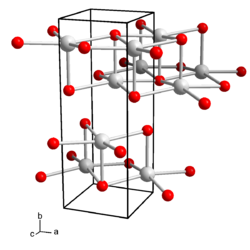
Wässrige Lösungen von Caesiumhydroxid reagieren stark basisch und ätzen Glas. Caesiumhydroxid kristallisiert orthorhombisch, Raumgruppe Cmcm (Raumgruppen-Nr. 63)Vorlage:Raumgruppe/63, mit den Gitterparametern a = 4,35 Å, b = 11,99 Å und c = 4,516 Å.[5] In der Kristallstruktur wird jedes Caesium-Kation von fünf Hydroxid-Anionen koordiniert, die Anionen koordinieren ihrerseits fünf Caesium-Ionen, so dass sich eine Schichtstruktur ergibt. Es sind auch Hydrate des Caesiumhydroxids bekannt. Das Monohydrat kristallisiert tetragonal, Raumgruppe I41/amd (Nr. 141)Vorlage:Raumgruppe/141[6]. Es sind auch hexagonale Formen des Monohydrats beobachtet worden.
Das Dihydrat, Cs(OH)·2 H2O kristallisiert orthorhombisch, Raumgruppe Pca21 (Nr. 29)Vorlage:Raumgruppe/29.[7] Das Trihydrat ist monoklin mit der Raumgruppe P21/n (Nr. 14, Stellung 2)Vorlage:Raumgruppe/14.2.[7]
Verwendung
Die Caesiumlauge ist eine hochwertige Base zur katalytischen Alkinylierung von Aldehyden und Ketonen.
Caesiumhydroxid wird als Elektrolyt in galvanischen Zellen verwendet.[8]
Einzelnachweise
- ↑ a b c d e Eintrag zu Cäsiumhydroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Inorganic Compounds, S. 4-57.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Caesiumhydroxid), abgerufen am 4. März 2020.
- ↑ Georg Brauer: Rubidium- und Cäsiumhydroxyd. In: Handbuch der Präparativen Anorganischen Chemie. Ferdinand Enke Verlag, Stuttgart 1954, S. 742.
- ↑ H. Jacobs, B. Harbrecht: Eine neue Darstellungsmethode für Caesiumhydroxid. In: Zeitschrift für Naturforschung B. 36, 1981, S. 270–271 (online).
- ↑ R. Černy, V. Favre-Nicolin, B. Bertheville: A tetragonal polymorph of caesium hydroxide monohydrate, CsOH·H2O, from X-ray powder data. In: Acta Crystallographica, C58, 2002, S. i31–i32, doi:10.1107/S0108270101021928.
- ↑ a b D. Mootz, H. Rütter: Hydrate schwacher und starker Basen. VII: Zum System Caesiumhydroxid-Wasser: Die Kristallstrukturen von CsOH·2 H2O und CsOH·3 H2O. In: Zeitschrift für anorganische und allgemeine Chemie, 608(2), 1992, S. 123–130, doi:10.1002/zaac.19926080218.
- ↑ Eintrag zu Caesium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.