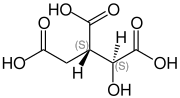
| Strukturformel
|

|
| Strukturformel ohne Stereoisomerie
|
| Allgemeines
|
| Name
|
Isocitronensäure
|
| Andere Namen
|
- 3-Carboxy-2-hydroxy-pentan-1,5-disäure
- 1-Hydroxypropan-1,2,3-tricarbonsäure
- Isozitronensäure
|
| Summenformel
|
C6H8O7
|
| Kurzbeschreibung
|
farbloses, kristallines Pulver[1]
|
| Externe Identifikatoren/Datenbanken
|
|
|
| Eigenschaften
|
| Molare Masse
|
192,13 g·mol−1
|
| Aggregatzustand
|
fest
|
| Löslichkeit
|
gut in Wasser[1]
|
| Sicherheitshinweise
|
|
|
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa).
|
Isocitronensäure ist ein farbloser, wasserlöslicher Feststoff. Sie ist ein Konstitutionsisomer der Citronensäure. Die Salze sind die Isocitrate.
Wenn in diesem Artikel oder in der wissenschaftlichen Literatur von „Isocitronensäure“ ohne weitere Angaben zur Stereochemie die Rede ist, ist die in der Natur vorkommende L-threo-Isocitronensäure, auch (+)-Isocitronensäure oder (2R,3S)-Isocitronensäure – ein Stoffwechselzwischenprodukt im Citratzyklus – gemeint. Die anderen drei Stereoisomere besitzen nur untergeordnete Bedeutung.
Eigenschaften
Isocitronensäure wird aufgrund ihrer drei Carboxygruppen (–COOH) zu den organischen Tricarbonsäuren (siehe Carbonsäure) gezählt. Zudem weist die Hydroxygruppe (–OH) an Position 2 des Kohlenstoffrückgrates sie als Hydroxycarbonsäure aus. Sie unterscheidet sich von der Citronensäure durch die Stellung dieser Hydroxygruppe, die bei der Citronensäure an Position 3 ist.
-
Citronensäure
-
Isocitronensäure
Isomerie
3-Carboxy-2-hydroxy-pentan-1,5-disäure ist chiral und besitzt zwei unterschiedlich substituierte Stereozentren, d. h., es existieren vier unterscheidbare Stereoisomere.
Die in der Natur vorkommende L-threo-Isocitronensäure wird auch als
- (2R,3S)-3-Carboxy-2-hydroxy-pentan-1,5-disäure,
- (2R,3S)-Isocitronensäure[3] oder
- (+)-Isocitronensäure[4]
bezeichnet.
| Isomere von Isocitronensäure
|
| Name
|
L-threo-Isocitronensäure
|
D-threo-Isocitronensäure
|
D-erythro-Isocitronensäure
|
L-erythro-Isocitronensäure
|
| Andere Namen
|
(+)-threo-Isocitronensäure
(2R,3S)-Isocitronensäure
(1R,2S)-1-Hydroxypropan-1,2,3-tricarbonsäure
|
(−)-threo-Isocitronensäure
(2S,3R)-Isocitronensäure
(1S,2R)-1-Hydroxypropan-1,2,3-tricarbonsäure
|
(−)-erythro-Isocitronensäure
(2S,3S)-Isocitronensäure
(1S,2S)-1-Hydroxypropan-1,2,3-tricarbonsäure
|
(+)-erythro-Isocitronensäure
(2R,3R)-Isocitronensäure
(1R,2R)-1-Hydroxypropan-1,2,3-tricarbonsäure
|
| Strukturformel
|
![]()
|

|
|

|
| CAS-Nummer
|
6061-97-8
|
55582-48-4
|
30810-51-6
|
1187-17-3
|
| 18979-21-0 (DL-threo-Isocitronensäure)
|
344-79-6 (DL-erythro-Isocitronensäure)
|
| 320-77-4 (unspez.)
|
| EG-Nummer
|
–
|
–
|
–
|
–
|
| 206-282-3 (unspez.)
|
| ECHA-Infocard
|
–
|
–
|
–
|
–
|
| 100.005.713 (unspez.)
|
| PubChem
|
440409
|
5318532
|
447805
|
439238
|
| 1198 (unspez.)
|
| DrugBank
|
–
|
–
|
–
|
–
|
| DB01727 (unspez.)
|
| Wikidata
|
Q27114011
|
Q27105259
|
Q27104505
|
Q66723041
|
| Q288927 (unspez.)
|
Vorkommen
Die Isocitronensäure beziehungsweise ihre Salze, die Isocitrate, sind ein Zwischenprodukt im Kohlenhydrat-Stoffwechsel aller sauerstoffverbrauchenden Lebewesen einschließlich des Menschen. Die Stoffwechselfolge (siehe Biochemie) wird als Citratzyklus bezeichnet.
Sie kommt in Äpfeln, Birnen, Himbeeren, Brombeeren und Johannisbeeren vor.
Herstellung
Eine großtechnische Herstellung ist bislang nicht etabliert, weder des Racemats, noch eines bestimmten Stereoisomers. Mit Hilfe der Hefe Yarrowia lipolytica gelang es jedoch, aus raffiniertem Sonnenblumenöl (2R,3S)-Isocitrat in größerer Menge und in einem günstigen Mengenverhältnis von Isocitrat zu Citrat herzustellen. Die beiden Komponenten werden nach dem Abfiltern der Biomasse über eine Elektrodialyse gewonnen und über eine Veresterung getrennt, bei dem der Citronensäureester kristallisiert und der Isocitronensäureester flüssig bleibt.[3]
Physiologie
(2R,3S)-Isocitrat ist Zwischenprodukt mehrerer Stoffwechselwege in allen Lebewesen. So entsteht es mithilfe der Aconitase in geringer Konzentration aus Citrat (über cis-Aconitat als Zwischenprodukt) im Rahmen des Citratzyklus.
Isocitrat wird weiterverarbeitet
Weblinks
Einzelnachweise
- ↑ a b Eintrag zu DL-Isocitric acid, trisodium salt hydrate bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b Datenblatt DL-Isocitric acid trisodium salt hydrate, ≥93% bei Sigma-Aldrich, abgerufen am 17. Februar 2013 (PDF).
- ↑ a b Heretsch, Thomas, Aurich, Krautscheid, Sicker & Giannis: Synthesen mit einem chiralen Baustein aus dem Citratzyklus: (2R,3S)-Isocitronensäure aus einer Fermentation mit Sonnenblumenöl. In: Angewandte Chemie, 120, 2008. doi:10.1002/ange.200705000.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 365, ISBN 978-3-906390-29-1.