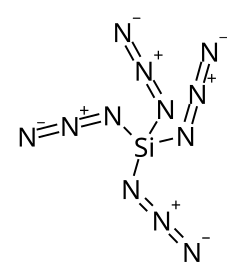
| Strukturformel
|
|
| Allgemeines
|
| Name
|
Siliciumtetraazid
|
| Andere Namen
|
Tetraazidosilan
|
| Summenformel
|
Si(N3)4
|
| Kurzbeschreibung
|
weißer kristalliner Feststoff[1]
|
| Externe Identifikatoren/Datenbanken
|
|
|
| Eigenschaften
|
| Molare Masse
|
196,17 g·mol−1
|
| Löslichkeit
|
löslich in Diethylether und Benzol[1][2]
|
| Sicherheitshinweise
|
|
|
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa).
|
Siliciumtetraazid ist eine thermisch instabile Silicium-Stickstoff-Verbindung mit einem Stickstoffgehalt von 85,7 %. Die hochenergetische Substanz neigt zu einer spontanen explosiven Zersetzung und konnte bisher nur in Lösung charakterisiert werden.[1][4] Eine weitere Koordination zur sechsfach koordinierten Struktur wie in Hexaazidosilicaten [Si(N3)6]2−[5] oder in Addukten mit zweiwertigen Liganden Si(N3)4L2[4] führt zu relativ stabilen, kristallinen Feststoffen, die bei Raumtemperatur normal gehandhabt werden können.
Darstellung und Gewinnung
Die Synthese von Siliciumtetraazid gelingt durch die Umsetzung von Siliciumtetrachlorid mit Natriumazid in benzolischer Lösung.[1][2]
![]()
Die Umsetzung von Siliciumtetrachlorid mit einem Überschuss an Natriumazid bei Raumtemperatur in Acetonitril führt zunächst zum Natriumhexaazidosilicat, welches durch Zugabe von zweiwertigen Liganden wie 2,2′-Bipyridin und 1,10-Phenanthrolin in stabile Siliciumtetraazid-Addukte umgewandelt werden kann.[4] Andere Basen wie Pyridin und Tetramethylethylendiamin reagieren nicht mit dem Hexaazidosilicatanion.[4]
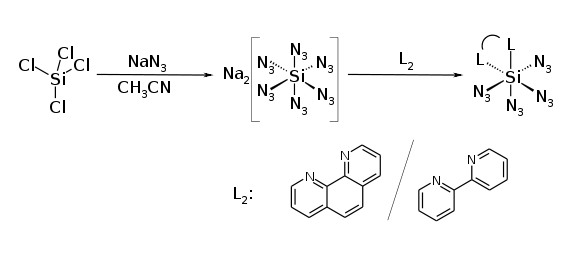
Eine weitere Darstellung eines Bis(triphenylphosphin)iminiumhexaazidosilicatsalzes ((PPN)2Si(N3)6, [Ph3P=NPPh3][Si(N3)6]) erfolgt durch die Umsetzung von Bis(triphenylphosphine)iminiumazid (PPNN3, [Ph3P=NPPh3]+N3−) mit Siliciumtetrachlorid in Acetonitril.[5]
Eigenschaften
Siliciumtetraazid ist eine weiße kristalline Substanz, die schon bei 0 °C zur explosionsartigen Zersetzung neigt.[1] Die reine Substanz, aber auch mit Siliciumchloridtriazid und Siliciumdichloriddiazid verunreinigte Proben können scheinbar ohne äußere Ursache z. B. bei der Lagerung spontan explodieren.[6] Die Verbindung ist hydrolyseempfindlich.[2] Der Stoff ist in Diethylether und Benzol löslich.[1]
Die Additionverbindung mit 2,2′-Bipyridin ist wesentlich stabiler. Hier wird ein Schmelzpunkt von 212 °C mit einer Schmelzenthalpie von 110 J·g−1 beobachtet. Die DSC-Messung zeigt ab 265 °C eine stark exotherme Zersetzung mit einer Zersetzungswärme von −2400 J·g−1.[4] Ein ähnliches Verhalten zeigt die Additionsverbindung mit 1,10-Phenanthrolin. Die als Hemiacetonitrilsolvat angefallene Verbindung gibt um 100 °C das gebundene Lösungsmittel ab, zeigt dann in einer DSC-Messung ab 240 °C eine stark exotherme Zersetzung mit einer Zersetzungswärme von −2300 J·g−1.[4] Die Zersetzungswärmen liegen höher als die von Natriumazid mit −800 J·g−1[7], aber noch unter den Werten für klassische Explosivstoffe wie RDX mit −4500 J·g−1.[4] Die Additionsverbindungen sind in Lösung stabil. Die IR- und 1H-NMR-spektroskopischen Daten zeigen keine Dissoziation in Siliciumtetraazid und 2,2'-Bipyridin bzw. 1,10-Phenanthrolin.[4] Das Bis(triphenylphosphin)iminiumhexaazidosilicatsalz ((PPN)2Si(N3)6) ist ebenfalls relativ stabil. Die Verbindung schmilzt bei 214 °C und zeigt in einer DSC-Messung ab 250 °C eine Zersetzungsreaktion.[5] Eine mit einem Massenspektrometer gekoppelte thermogravimetrische Untersuchung ergab als Zersetzungsprodukte Stickstoff, Siliciumtetraazid und Stickstoffwasserstoffsäure.[5]
Verwendung
Eine praktische Verwendung von freiem Siliciumtetraazid ist wegen der hohen Instabilität ausgeschlossen. In Lösung bietet sich die Substanz trotzdem als Ausgangsstoff für die Synthese stickstoffreicher Verbindungen an.[4] Eine Anwendung als Hilfsstoff bei der Herstellung von Polyolefinpolymeren wurden patentiert.[8] Die wesentlich stabileren Addukte können als energetische Verbindungen oder als Initialsprengstoffe als Ersatz für das Bleiazid dienen.[4]
Einzelnachweise
- ↑ a b c d e f Wilberg, E.; Michaud, H.: Zur Kenntnis eines Siliciumterazids Si(N3)4. In: Zeitschrift für Naturforschung B. 9, 1954, S. 500 (online).
- ↑ a b c Gmelins Handbook of Inorganic Chemistry, 8th Edition, Silicon Supplement Volume B4, Springer-Verlag 1989, S. 46.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d e f g h i j Portius, P.; Filippou, A.C.; Schnakenburg, G.; Davis, M.; Wehrstedt, K.-D.: Neutrale Lewis-Basen-Addukte des Siliciumtetraazids in Angew. Chem. 122 (2010) S. 8185–8189, doi:10.1002/ange.201001826
- ↑ a b c d Filippou, A.C.; Portius, P.; Schnakenburg, G.: The Hexaazidosilicate(IV) Ion: Synthesis, Properties, and Molecular Structure in J. Am. Chem. Soc. 124 (2002) S. 12396–12397, doi:10.1021/ja0273187
- ↑ Bretherick's Handbook of Reactive Chemical Hazards, 7th revised edition, Academic Press 2006, ISBN 978-0123725639.
- ↑ T. Grewer: Thermal Hazards of Chemical Reactions, Industrial Safety Series 4, Elsevier 1994.
- ↑ Patent EP0206034B1: Polyolefinzusammensetzung. Angemeldet am 5. Juni 1986, veröffentlicht am 22. Januar 1992, Anmelder: Idemitsu Petrochemical Co Ltd, Erfinder: Manabu Nomura, Ryuzo Tomomatsu, Toshifumi Shimazaki.