Imidazol
|
|

|
| Nazewnictwo
|
|
|
| Nomenklatura systematyczna (IUPAC)
|
1H-imidazol
|
| Inne nazwy i oznaczenia
|
| 1,3-diazol, 1,3-diaza-2,4-cyklopentadien
|
|
| Ogólne informacje
|
| Wzór sumaryczny
|
C3H4N2
|
| Masa molowa
|
68,08 g/mol
|
| Wygląd
|
białe lub żółte kryształy o zapachu aminowym
|
| Identyfikacja
|
| Numer CAS
|
288-32-4
13028-65-4 (cytrynian)
1467-16-9 (chlorowodorek)
2200-49-9 (octan)
5587-42-8 (sól sodowa)
|
| PubChem
|
795
|
| DrugBank
|
DB03366
|
|
|
| InChI
|
InChI=1S/C3H4N2/c1-2-5-3-4-1/h1-3H,(H,4,5)
|
| InChIKey
|
RAXXELZNTBOGNW-UHFFFAOYSA-N
|
|
| Właściwości
|
|
|
| Gęstość
|
| 1,0303 g/cm³ (101 °C)[1]; ciało stałe
|
|
|
| Rozpuszczalność w wodzie
|
| 2060 g/kg (19 °C)[4]
|
| w innych rozpuszczalnikach
|
| rozpuszczalny w eterze dietylowym, acetonie, pirydynie, dobrze w etanolu, słabo w benzenie[1]
|
|
|
| Temperatura topnienia
|
88,52 °C[1]
|
| Temperatura wrzenia
|
257 °C[1]
|
| logP
|
−0,08[2]
|
| Kwasowość (pKa)
|
6,99[3]
|
| Współczynnik załamania
|
1,4801 (589 nm, 101 °C)[1]
|
|
|
|
|
|
| Podobne związki
|
| Podobne związki
|
pirazol, pirol, triazol, tetrazol
|
| Pochodne biologicznie czynne
|
puryna, histamina, histydyna, metronidazol, pilokarpina, tinidazol, ornidazol, mykonazol
|
Jeżeli nie podano inaczej, dane dotyczą
stanu standardowego (25 °C, 1000 hPa)
|
|
|
Imidazol – heterocykliczny związek chemiczny o charakterze aromatycznym. Tautomerem 1H-imidazolu jest niearomatyczny 2H-imidazol (oba są 1,3-diazolami), a metamerem – aromatyczny pirazol (1,2-diazol).
Substancje zawierające w swojej strukturze pierścień imidazolowy są rozpowszechnione w przyrodzie, wiele z nich ma istotne funkcje biologiczne. Przykładami mogą być histydyna czy histamina. Ugrupowanie imidazolowe obecne jest w alkaloidach imidazolowych oraz w wielu lekach o charakterze przeciwgrzybicznym, np. nitroimidazolu.
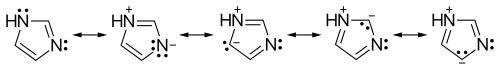
Budowa cząsteczki
Imidazol tworzy pięcioczłonowy, płaski pierścień o charakterze aromatycznym (posiada sekstet elektronów π i spełnia regułę Hückla)[8][9]. Ponieważ jeden z atomów wodoru jest labilny i może być położony na jednym z dwóch atomów azotu, imidazol może występować w dwóch równoważnych formach tautomerycznych. Z powodu znacznego momentu dipolowego związek ten jest wysoce polarny, dlatego też cechuje się dobrą rozpuszczalnością w wodzie i innych rozpuszczalnikach polarnych.
Występowanie
Wiele naturalnych związków biologicznie czynnych zawiera ugrupowanie imidazolowe. Jednym z najistotniejszych jest histydyna, będąca aminokwasem białkowym. Bardzo wiele enzymów zawiera reszty histydynowe w swoich centrach aktywnych. Aminokwas ten może ulec dekarboksylacji do histaminy, będącej jedną z tzw. amin biogennych:

Schemat dekarboksylacji histydyny do histaminy
Związek ten odpowiedzialny jest za występowanie wielu objawów odpowiedzi alergicznych oraz pełni rolę neurotransmitera w układzie nerwowym.
Otrzymywanie
Imidazol został po raz pierwszy otrzymany przez Heinricha Debusa w 1858 roku, jednakże wiele pochodnych tego związku było znanych już w latach 40. XIX wieku. Synteza imidazolu została przeprowadzona przy użyciu glioksalu i formaldehydu w środowisku amoniaku[10]:
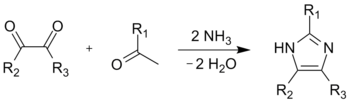
Synteza imidazolu metodą Debusa (R1, R2, R3 = H)
Metoda ta, mimo stosunkowo niskiej wydajności, nadal znajduje zastosowanie do otrzymywania C-podstawionych imidazoli.
Obecnie istnieje wiele modyfikacji tej metody. W jednej z nich reagentami są dibenzoil, formaldehyd oraz amoniak, rozpuszczalnikiem lodowaty kwas octowy, a proces jest wspomagany mikrofalowo. Produktem tej reakcji jest 2,4,5-trifenyloimidazol[11].
Otrzymywanie pochodnych imidazolu
Istnieje wiele metod pozwalających na syntezę układu imidazolowego. Wiele z nich pozwala na wprowadzenie do pierścienia różnych grup funkcyjnych. Syntezy te mogą zostać sklasyfikowane na podstawie ilości tworzonych wiązań, koniecznych do utworzenia układu heterocyklicznego. Przykładowo synteza Debusa wymaga uformowania wiązań (1,2), (3,4) oraz (1,5) przez co zaliczana jest do grupy syntez poprzez 3 wiązania. Poniżej zostaną przedstawione wybrane metody syntezy układu imidazolowego oraz jego pochodnych funkcjonalnych.
Tworzenie jednego wiązania
Wiązania (1,5) oraz (3,4) mogą zostać utworzone w wyniku reakcji imidu z α-aminoaldehydem lub α-aminoacetalem w wyniku czego ma miejsce cyklizacja prowadząca do utworzenia pierścienia imidazolowego:

Tworzenie dwóch wiązań
Wiązania (1,2) oraz (2,3) mogą zostać łatwo utworzone poprzez reakcję 1,2-diaminoalkanu z alkoholem, aldehydem lub kwasem karboksylowym w wysokiej temperaturze. Proces wymaga użycia katalizatora takiego jak tlenek glinu lub platyna, który służy do dehydrogenacji powstałego produktu kondensacji.
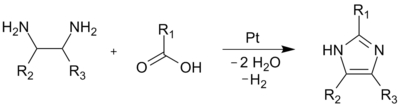
Wiązania (1,2) i (3,4) mogą zostać utworzone przez ogrzewanie N-podstawionych α-aminoketonów z formamidem. Pomimo relatywnie niskiej wydajności metoda ta jest dogodna do syntezy 1,4-dipodstawionych pochodnych imidazolu.

Tworzenie czterech wiązań
Obecnie jest to główna metoda syntezy, charakteryzuje się ona wysoką wydajnością także w przypadku otrzymywania pochodnych imidazolu. Zasadniczo stanowi ona adaptację metody nazywanej syntezy Debusa-Radziszewskiego. Wyjściowym materiałem są podstawiony glioksal, aldehyd, amina oraz amoniak lub sól amoniowa[12].
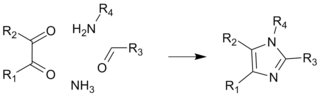
Inne drogi syntezy
Możliwe jest otrzymanie imidazolu poprzez fotolizę pochodnych tetrazolu. Proces daje dobrą wydajność jedynie wtedy, gdy 1-winylotetrazol jest efektywnie generowany ze związków cynoorganicznych takich jak 2-tributylostannylotetrazol.

Innym przykładem syntezy układu imidazolowego jest reakcja w fazie gazowej. Zachodzi ona w zakresie temperatur pomiędzy 340 a 480 °C, substratami są formamid, etylenodiamina oraz wodór. Reakcja wymaga użycia katalizatorów metalicznych i prowadzi do uzyskania bardzo czystego produktu.
Możliwe jest również otrzymywanie arylowych pochodnych imidazolu poprzez wykorzystanie związków dikarbonylowych:

Właściwości
Imidazol wykazuje własności amfoteryczne, tj. może być zarówno donorem protonów (kwasowa grupa >N−H), jak i akceptorem protonów (zasadowa grupa =N−). Imidazol jest bardzo słabym kwasem, jego pKa wynosi 14,5, co czyni go kwasem słabszym od kwasów karboksylowych, fenoli oraz imidów, jednakże mocniejszym od alkoholi. pKBH+
imidazolu wynosi 7, co oznacza, że jest on stosunkowo słabą zasadą, znacznie słabszą od amin alifatycznych (pKBH+
ok. 10–11), jednak ok. 100-krotnie silniejszą od pirydyny i amin aromatycznych (pKBH+
ok. 5).
Zastosowanie
Zarówno sam imidazol, jak i związki zawierające układ imidazolowy znalazły wiele zastosowań. Jednym z zastosowań imidazolu jest oczyszczanie białek modyfikowanych genetycznie. Jeżeli białko takie posiada na jednym z końców sekwencję złożona z kilku powtórzonych histydyn to może ono zostać oczyszczone za pomocą chromatografii powinowactwa na złożu zawierającym kationy niklowe. Roztwór imidazolu jest wykorzystywany do wypłukiwania związanych białek (jest to możliwe z uwagi na to, że kompleksy tworzone z niklem przez cząsteczki imidazolu są stabilniejsze niż te tworzone przez peptyd polihistydynowy).
Zastosowania przemysłowe
Wiele pochodnych imidazolu ma zastosowanie w przemyśle i technice. Termostabilne tworzywo sztuczne, polibenzoimidazol zbudowane jest z polimerycznych łańcuchów, zawierających reszty imidazolowe połączone z pierścieniami benzenu. Wiele związków stosowanych w elektronice oraz przemyśle fotograficznym także zawiera pierścień imidazolowy. Sam imidazol jest często stosowany jako inhibitor procesów korozji wielu metali przejściowych takich jak miedź.
Zastosowania medyczne
Ugrupowanie imidazolowe wchodzi w skład wielu leków. Syntetyczne pochodne imidazolu zawarte są w wielu fungicydach, stosowanych w leczeniu poważnych grzybic[13] oraz lekach skierowanych przeciw pierwotniakom oraz nadciśnieniu tętniczemu. Pierścień imidazolu jest obecny w cząsteczce teofiliny, będącej alkaloidem stymulującym ośrodkowy układ nerwowy. Ponadto pierścień ten występuje w merkaptopurynie stosowanej w leczeniu niektórych typów białaczek.
Przypisy
- ↑ a b c d e f Haynes 2016 ↓, s. 3-318.
- ↑ a b c Imidazole, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 27150 [dostęp 2017-01-04] (niem. • ang.).
- ↑ Haynes 2016 ↓, s. 5-93.
- ↑ Haynes 2016 ↓, s. 5-154.
- ↑ Haynes 2016 ↓, s. 9-63.
- ↑ a b Imidazol (nr 56750) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2017-01-04]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Imidazol (nr 56750) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2017-01-04]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ JonathanJ. Clayden JonathanJ. i inni, Organic Chemistry, Oxford University Press, 2001, s. 203, ISBN 978-0-19-850346-0 (ang.).
- ↑ Francis A.F.A. Carey Francis A.F.A., Robert M.R.M. Giuliano Robert M.R.M., Organic Chemistry, wyd. 8, McGraw-Hill, 2009, s. 446, ISBN 978-0-07-340261-1 .
- ↑ Heinrich Debus. Ueber die Einwirkung des Ammoniaks auf Glyoxal. „Annalen der Chemie und Pharmacie”. 107 (2), s. 199–208, 1858. DOI: 10.1002/jlac.18581070209.
- ↑ R. David Crouch, Jessica L. Howard, Jennifer L. Zile, Kathryn H. Barker. Microwave-Mediated Synthesis of Lophine: Developing a Mechanism To Explain a Product. „Journal of Chemical Education”. 83 (11), s. 1658, 2006. DOI: 10.1021/ed083p1658.
- ↑ A.J. Arduengo, F.P. Gentry, P.K. Taverkere, H.E. Simmons: Patent US 6177575: Process for Manufacture of Imidazoles. 2001. Brak numerów stron w książce
- ↑ Leon Shargel: Comprehensive Pharmacy Review. Wyd. 6. s. 930.
Bibliografia