Oksybutynina
|
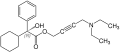
| Enancjomer R
|
|
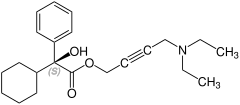
Enancjomer S
|
| Ogólne informacje
|
| Wzór sumaryczny
|
C22H31NO3
|
| Masa molowa
|
357,49 g/mol
|
| Identyfikacja
|
| Numer CAS
|
5633-20-5
|
| PubChem
|
4634
|
| DrugBank
|
DB01062
|
| InChI
|
InChI=1S/C22H31NO3/c1-3-23(4-2)17-11-12-18-26-21(24)22(25,19-13-7-5-8-14-19)20-15-9-6-10-16-20/h5,7-8,13-14,20,25H,3-4,6,9-10,15-18H2,1-2H3
|
| InChIKey
|
XIQVNETUBQGFHX-UHFFFAOYSA-N
|
|
|
|
| Farmakokinetyka
|
|
|
| Okres półtrwania
|
12 – 13 h
|
Wiązanie z białkami
osocza i tkanek
|
91% – 93%
|
|
|
|
Oksybutynina – organiczny związek chemiczny, lek antycholinergiczny używany głównie do leczenia problemów związanych z pęcherzem i oddawaniem moczu, tj. nietrzymanie moczu związane z nadreaktywnością mięśni wypieracza pęcherza moczowego.
Na zachodzie (np. w USA) stosowana także w leczeniu nadpotliwości (wykorzystywane są wówczas jej ogólne właściwości parasympatykolityczne). Jest związkiem chiralnym, produkt farmaceutyczny jest mieszaniną racemiczną obu enancjomerów[1][2].
Oksybutynina może być podawana doustnie i w postaci roztworu soli fizjologicznej, we wlewach dopęcherzowych. Podawana doustnie, powoduje szereg stosunkowo uciążliwych skutków ubocznych jak suchość w jamie ustnej, rozszerzenie źrenic, niewyraźne widzenie, tachykardię zatokową, zaparcia stolca, jak również zaburzenia pamięci. Podawana miejscowo (we wlewach) nie wykazuje działań niepożądanych tego typu.
Farmakodynamika
Oksybutynina jest kompetytywnym antagonistą acetylocholinowych receptorów muskarynowych M1, M2, M3, M4 i M5. Pożądany efekt terapeutyczny (działanie na pęcherz) jest osiągany tylko dzięki blokowaniu receptorów M3 – stosunkowo nieselektywna równoczesna blokada pozostałych typów tych receptorów odpowiada praktycznie wyłącznie za skutki uboczne. Może być to jednak wykorzystane w objawowym leczeniu nadpotliwości, przy zachowaniu stosownej ostrożności.
Jej aktywny farmakologicznie metabolit, N-deetylooksybutynina, może osiągać we krwi poziom 6-krotnie wyższy niż lek macierzysty[3].
Farmakokinetyka
Oksybutynina jest metabolizowana przez układ wątrobowego cytochromu P450. Enzymy metabolizujące (na drodze deetylacji) ten lek do równie aktywnego metabolitu, N-deetylooksybutyniny, to CYP3A4 i CYP3A5.
Dodatkowo sama oksybutynina hamuje dość wyraźnie enzym CYP2D6, co należy uwzględnić w przypadku przyjmowania leków i innych substancji metabolizowanych przez ten enzym. Po dalszym metabolizmie, kolejne nieaktywne metabolity leku są wydalane z moczem (niezmieniona oksybutynina oraz deetylooksybutynina, wykrywane w moczu, stanowią odpowiednio po mniej niż 0,1% przyjętej dawki leku), po uprzednim przypuszczalnym sprzęganiu z kwasem glukuronowym lub w postaci wolnej.
Działanie psychoaktywne
W dawkach 10–20 mg (lub nieco wyższych, co jednak wiąże się z ryzykiem poważnego zatrucia antycholinergicznego podobnego do efektów atropiny), przyjmowanych doustnie, oksybutynina może wykazywać działanie psychoaktywne właściwe deliriantom, jak uczucie śnienia na jawie, efekty wizualne (podobne do majaczenia w gorączce – tak jak i w przypadku przyjęcia sporej dawki atropiny), splątanie i depersonalizacja[potrzebny przypis]. Część użytkowników nie doświadcza jednak wcale takich efektów, a jedynie rozszerzenia źrenic, wyraźnego osłabienia i uczucia zmęczenia (spowodowanego znacznym przyblokowaniem przekaźnictwa acetylocholinergicznego) i znacznej suchości w ustach.
Przypisy
- ↑ J.F.J.F. Kachur J.F.J.F. i inni, R and S enantiomers of oxybutynin: pharmacological effects in guinea pig bladder and intestine, „The Journal of Pharmacology and Experimental Therapeutics”, 247 (3), 1988, s. 867–872, ISSN 0022-3565, PMID: 2849672 .
- ↑ L.L. Noronha-Blob L.L., J.F.J.F. Kachur J.F.J.F., Enantiomers of oxybutynin: in vitro pharmacological characterization at M1, M2 and M3 muscarinic receptors and in vivo effects on urinary bladder contraction, mydriasis and salivary secretion in guinea pigs, „The Journal of Pharmacology and Experimental Therapeutics”, 256 (2), 1991, s. 562–567, ISSN 0022-3565, PMID: 1993995 .
- ↑ Allen B. Reitz, Suneel K. Gupta, Yifang Huang, Michael H. Parker, and Richard R. Ryan. The preparation and human muscarinic receptor profiling of oxybutynin and N-desethyloxybutynin enantiomers. „Med Chem”. 3 (6), s. 543–545, 2007. DOI: 10.2174/157340607782360353. PMID: 18045203.