| Natria kvartionato
|
![]()
|
Kemia strukturo de la
Natria kvartionato
|
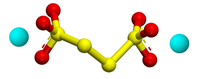
|
Tridimensia kemia strukturo de la
Natria kvartionato
|
| Alternativa(j) nomo(j)
|
| Natria salo de kvartionata acido
|
| Kemia formulo |
Na2S4O6
|
| CAS-numero-kodo |
|
| ChemSpider kodo |
140074
|
| PubChem-kodo |
203055
|
| Fizikaj proprecoj
|
| Molmaso |
- 270,2399 (anhidra)
- 306.2665 (duhidrata) g mol−1
|
| Smiles |
O.[Na].OS(=O)(=O)SSS(O)(=O)=O
|
| Denseco |
2.1 g/cm3
|
| Sekurecaj Indikoj
|
| Risko |
R36 R37 R38
|
| Sekureco |
S26 S36
|
| Pridanĝeraj indikoj
|
| Danĝero
|
| GHS etikedigo de kemiaĵoj[1]
|
| GHS Damaĝo-piktogramo |
|
| GHS Signalvorto |
Averto
|
| GHS Deklaroj pri damaĝoj |
H315, H319, H335
|
| GHS Deklaroj pri antaŭgardoj |
P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P312, P321, P332+313, P337+313, P362, P403+233, P405, P501
|
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo
(25 °C kaj 100 kPa)
|
Natria kvartionato, kvartionato de natrio aŭ Na2S4O6 estas neorganika okso-kombinaĵo de natrio kaj sulfuro, iom simila al molekuloj de natria tiosulfato kunligitaj per du sulfuratomoj. Natria kvartionato formiĝas per oksidado de natria tiosulfato kaj likva jodo, kies salo rezultanta povas izoliĝi el la solvaĵo per frakcia kristaliĝo.
Historio
Kvartionatoj kaj kvartionata acido estis unue preparataj de Fordos kaj Gelis, en 1842, dum analizofarado de granda nombro da komercaj saloj, kiuj ili alnomis "hiposulfitoj", por kontroli ĉu ili havis la saman komponadon. Dum tiu laboro, ili provis oksidigi solvaĵon da saloj kun jodo por konverti sulfuron al sulfato.
Anstataŭ formiĝo de sulfato, unu nova sulfurkomponaĵo formiĝis, kies analizo elmontris havi ĝeneralan formulon MS4O6. Ekde la malkovro de la kvartionatoj multe da laboro estis dediĉita al ili kaj la rezultoj atingitaj ne sufiĉe akordiĝas. La ĉefa kialo por tia polemiko estas ke la kvartionatoj prepariĝis elde la solvaĵo de Wackenroder, kiu ne havis unuforman komponadon.[2]
Sintezo

Literaturo
Vidu ankaŭ
Referencoj