| Kalia nitrito
|
|
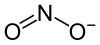
Plata kemia strukturo de la
Kalia nitrito
|

|
Tridimensia kemia strukturo de la
Kalia nitrito
|
| Alternativa(j) nomo(j)
|
- Kalia salo de nitrita acido
- Nitrito de kalio
- Kalia salo de nitroza acido
|
| Kemia formulo |
KNO2
|
| CAS-numero-kodo |
7758-09-0
|
| ChemSpider kodo |
22857
|
| PubChem-kodo |
516910
|
| Merck Index |
15,7770
|
| Fizikaj proprecoj
|
| Aspekto |
blankaj aŭ flavaj higroskopaj kristaloj
|
| Molmaso |
85.10379 g·mol-1
|
| Denseco |
1.914986g cm−3
|
| Fandpunkto |
440.02 °C
|
| Bolpunkto |
537 °C
|
| Acideco (pKa) |
3.32
|
| Solvebleco |
Akvo:3120 g/L
|
| Mortiga dozo (LD50) |
235 mg/kg (buŝe)
|
| Sekurecaj Indikoj
|
| Riskoj |
R8 R25 R50
|
| Sekureco |
S45 S61
|
| Pridanĝeraj indikoj
|
| Danĝero
|
| GHS etikedigo de kemiaĵoj
|
| GHS Damaĝo-piktogramo |
|
| GHS Signalvorto |
Damaĝo
|
| GHS Deklaroj pri damaĝoj |
H272, H301, H311, H400, H410[1]
|
| GHS Deklaroj pri antaŭgardoj |
P210, P220, P221, P264, P270, P273, P280, P301+310, P302+352, P312, P321, P330, P361, P363, P370+378, P391, P405, P501
|
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo
(25 °C kaj 100 kPa)
|
Kalia nitrito estas neorganika salo, blanka aŭ iomete flava substanco, tre higroskopa substanco, kaj tre solvebla en akvo kreante jonojn de kalio kaj nitrito (NO2-). Ĝi estas forta oksidiganto kaj povas akceli bruladon de aliaj materialoj.
Samkiel ĉiuj nitritoj, kalia nitrito estas toksa substanco kiam englutita, kaj laboratoriaj testoj sugestas ke ĝi povas esti genetike mutacia aŭ teratogenia. Biologie, kalia nitrito estas vazodilatanto kaj uzata en traktado kontraŭ venenigo per cianido.
Historio
Nitritoj ĉeestas sub spurniveloj en la sojlo, naturakvoj, plantaj kaj bestaj histoj kaj sterkoj. La pura formo de la nitrito estis unue priskribita de la fama sveda kemiisto Carl Wilhelm Scheele (1742-1786) kiam li laboradis en la laboratorio de sia apoteko en la urbo Köping. Li varmigis kalian nitraton ĝis ruĝiĝo dum duono da horo kaj estigis tion kion li agnoskis kiel "nova salo". Iom post, la du komponaĵoj (kaliaj nitrato kaj nitrito) estis karakterizitaj de Eugène-Melchior Péligot (1811-1890) kiu klarigis la reakcion.
Sintezoj
Sintezo 1

|
Sintezo 2
- Kalia nitrito estas preparata per varmo-malkomponado de kalia nitrato:
|

|
Sintezo 3
- Teknike, kalia nitrito povas prepariĝi per agado de la nitrogenaj oksidoj en solvaĵo de kalia karbonato:
|

|
Reakcioj
Nitritoj kaj kalia nitrito uzatas por estigo de nitrogenaj oksidoj, laŭ elmontras la jenajn ekvaciojn:
Reakcio 1
Reakcio 2
Reakcio 3
|
3 KNO2 + KNO3 + Cr2O3 → 2 K2CrO4 + 4 NO ↑
|
Literaturo
Vidu ankaŭ
Referencoj
| Neorganikaj saloj de kalio |
|---|
 | |
|