|
Acido 2,4-diidrossibenzoico
L'acido 2,4-diidrossibenzoico o acido β-resorcilico è un acido fenolico, derivato sia dall'acido benzoico che dal resorcinolo (1,3-diidrossibenzene). La sua struttura è costituita da un anello benzenico a cui è attaccato un gruppo carbossilico  e due gruppi idrossilici e due gruppi idrossilici  in posizione 2 e 4 dell'anello benzenico. È uno degli isomeri dell'acido diidrossibenzoico. in posizione 2 e 4 dell'anello benzenico. È uno degli isomeri dell'acido diidrossibenzoico.
Si presenta come una polvere cristallina bianca, solubile in etanolo e leggermente solubile in acqua calda.
Classificato dal JECFA[1] e dal regolamento europeo[2] tra le sostanze aromatizzanti, ha un lieve odore fenolico.
Occorrenza in natura
Ricorrendo in natura raramente, rispetto ad altri acidi fenolici e metaboliti dei polifenoli, l'acido 2,4-diidrossibenzoico è stato isolato in alcune piante o frutti: Matricaria recutita, Robinia pseudoacacia, Pterocarpus santalinus, Adenanthera pavonina, Sebertia acuminata, Taxus baccata, bacche di Vaccinium macrocarpon e olive.[3][4][5]
È un prodotto di degradazione dei glicosidi della cianidina in colture cellulari di amarene. È anche un metabolita presente nel plasma umano dopo il consumo di succo di mirtillo rosso.[6][7]
Produzione
Sintesi chimica
L'acido 2,4-diidrossibenzoico può essere sintetizzato da resorcinolo e bicarbonato di potassio mediante la reazione di Kolbe,[8] 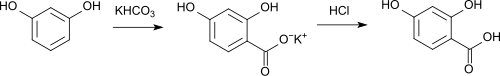
Utilizzo
Il principale utilizzo industriale dell'acido 2,4-diidrossibenzoico è come intermedio o reagente per la produzione di prodotti di chimica fine, in particolare nell'ambito dei coloranti o degli esplosivi.[9]
Le più comuni reazioni utilizzate sono:
Bromurazione
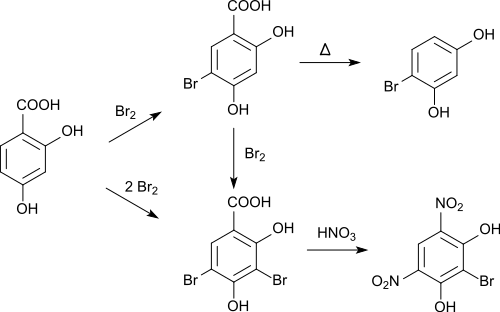
La bromurazione di acido 2,4-diidrossibenzoico con bromo in acido acetico glaciale inizialmente porta a 5-bromo-2,4-diidrossibenzoico, che può essere convertita in 4-bromoresorcina tramite decarbossilazione.[10] Con ulteriore aggiunta di bromo si forma l'acido 3,5-dibromobenzoico. Se quest'ultimo viene trattato con acido nitrico, si forma la 4,6-dinitro-2-bromoresorcina lasciando il gruppo carbossilico e un atomo di bromo.[11][12]
 . .
Nitrazione
la nitrazione avviene inizialmente con un gruppo nitro  in posizione 5. Se il processo viene continuato con acido nitrico fumante, un secondo gruppo nitro verrà sostituito in posizione 3. Il trattamento successivo con acido nitrico produce acido stifnico.[13] Negli acidi 2,4 diidrossibenzoici derivati (5-nitro e 3,5-dinitro) il gruppo carbossilico può essere rimosso mediante riscaldamento per dare 4-nitroresorcina o 2,4-dinitroresorcina.[14] L'acido 5-nitro-2,4-diidrossibenzoico può essere ridotto con stagno e acido cloridrico per ottenere il corrispondente acido 5-ammino-2,4-diidrossibenzoico.[15][13] in posizione 5. Se il processo viene continuato con acido nitrico fumante, un secondo gruppo nitro verrà sostituito in posizione 3. Il trattamento successivo con acido nitrico produce acido stifnico.[13] Negli acidi 2,4 diidrossibenzoici derivati (5-nitro e 3,5-dinitro) il gruppo carbossilico può essere rimosso mediante riscaldamento per dare 4-nitroresorcina o 2,4-dinitroresorcina.[14] L'acido 5-nitro-2,4-diidrossibenzoico può essere ridotto con stagno e acido cloridrico per ottenere il corrispondente acido 5-ammino-2,4-diidrossibenzoico.[15][13]

Clorazione
La clorazione con gas di cloro  in una soluzione riscaldata di acido acetico glaciale dell'acido 2,4-diidrossibenzoico avviene in posizione 5,formando acido 5-cloro-2,4-diidrossibenzoico).[16][17] L'acido 5-cloro-2,4-diidrossibenzoico condensa con resorcina o clororesorcina a tetraidrossibenzofenoni, che quindi reagiscono mediante chiusura ad anello per dare l'equivalente 7-cloro-3,6-diidrossossantoni. Se si utilizza acido 5-nitroico al posto dell'acido 5-clorico, la reazione si arresta al chetone e non c'è chiusura dell'anello.[18] in una soluzione riscaldata di acido acetico glaciale dell'acido 2,4-diidrossibenzoico avviene in posizione 5,formando acido 5-cloro-2,4-diidrossibenzoico).[16][17] L'acido 5-cloro-2,4-diidrossibenzoico condensa con resorcina o clororesorcina a tetraidrossibenzofenoni, che quindi reagiscono mediante chiusura ad anello per dare l'equivalente 7-cloro-3,6-diidrossossantoni. Se si utilizza acido 5-nitroico al posto dell'acido 5-clorico, la reazione si arresta al chetone e non c'è chiusura dell'anello.[18]

Metossilazione
Quando l'acido 2,4-diidrossibenzoico reagisce con lo iodometano in metanolo, inizialmente viene metilato solo il gruppo para idrossile formando acido 2-idrossi-4-metossibenzoico. La metilazione anche del secondo gruppo idrossile è difficile.[19]

Isomerizzazione
In caso di riscaldamento prolungato di una soluzione acquosa del sale sodico dell'acido 2,4-diidrossibenzoico, avviene l'isomerizzazione parziale ad acido 2,6-diidrossibenzoico (acido γ-resorcilico).
Note
- ^ Food safety and quality: details, su fao.org. URL consultato il 27 marzo 2021.
- ^ L_2012267IT.01000101.xml, su eur-lex.europa.eu. URL consultato il 27 marzo 2021.
- ^ KNApSAcK Metabolite Information - 89-86-1, su knapsackfamily.com. URL consultato il 28 marzo 2021.
- ^ Dr. Duke's Phytochemical and Ethnobotanical Databases at NAL [collegamento interrotto], su phytochem.nal.usda.gov. URL consultato il 28 marzo 2021.
- ^ Showing all foods in which the polyphenol 2,4-Dihydroxybenzoic acid is found - Phenol-Explorer, su phenol-explorer.eu. URL consultato il 28 marzo 2021.
- ^ (EN) Kai Zhang e Yuegang Zuo, GC-MS Determination of Flavonoids and Phenolic and Benzoic Acids in Human Plasma after Consumption of Cranberry Juice, in rivista of Agricultural and Food Chemistry, vol. 52, n. 2, 2004-01, pp. 222–227, DOI:10.1021/jf035073r. URL consultato il 28 marzo 2021.
- ^ (EN) Navindra P. Seeram, Leslie D. Bourquin e Muraleedharan G. Nair, Degradation Products of Cyanidin Glycosides from Tart Cherries and Their Bioactivities, in rivista of Agricultural and Food Chemistry, vol. 49, n. 10, 2001-10, pp. 4924–4929, DOI:10.1021/jf0107508. URL consultato il 28 marzo 2021.
- ^ (EN) Preparation of 2,4-dihydroxybenzoic acid, 1º settembre 1989. URL consultato il 28 marzo 2021.
- ^ (EN) Hans Dressler, Resorcinol, 1994, DOI:10.1007/978-1-4899-0999-2. URL consultato il 28 marzo 2021.
- ^ R. B. Sandin, R. A. McKee, 4-Bromoresorcinol, vol. 17, n. 23, 1937, DOI:10.15227/orgsyn.017.0023.
- ^ F. v. Hemmelmayr, Über einige neue Derivate der Dioxybenzoesäuren, in Monatshefte für Chemie, vol. 33, 1912, pp. 971–998, DOI:10.1007/BF01552742.
- ^ J.Zehenter, Über einige Derivate der α-Dioxybenzoesäure, in Monatshefte für Chemie, vol. 2, 1881, pp. 468–483, DOI:10.1007/BF01516530.
- ^ a b F.v.Hemmelmayr, Über die Einwirkung von Salpetersäure auf β-Resorcylsäure und einige Derivate der letzteren, in Monatshefte für Chemie, vol. 25, n. 1, 1904, pp. 21–45, DOI:10.1007/BF01540190.
- ^ F.v.Hemmelmayr, Über Nitroderivate der β-Resorcylsäure [2,4-Dioxybenzencarbonsäure, in Monatshefte für Chemie, vol. 26, n. 2, 1905, pp. 185–198, DOI:10.1007/BF01532170.
- ^ (EN) PubChem, 5-Amino-2,4-dihydroxybenzoic acid, su pubchem.ncbi.nlm.nih.gov. URL consultato il 28 marzo 2021.
- ^ F. Hemmelmayr, T. Meyer, Über den Einfluß verschiedener Substituenten auf die Haftfestigkeit der Karboxylgruppen in substituierten aromatischen Säuren. Einfluß einer zweiten Karboxylgruppe und relative Wirkung von Chlor und Brom, in Monatshefte für Chemie, vol. 46, 1925, pp. 143–156, DOI:10.1007/BF01558962.
- ^ R. B. Sandin, R. A. McKee, Orientation in the Benzene Ring. The Preparation of 5-Chloro-β-resorcylic Acid, in J. Am. Chem. Soc., vol. 57, n. 6, 1935, pp. 1077–1078, DOI:10.1021/ja01309a032.
- ^ R. Kurduker, N. V. Subba Rao, Search for physiologically active compounds, in Proceedings of the Indian Academy of Sciences – Section A, vol. 57, n. 5, 1963, pp. 280–287, DOI:10.1007/BF03049025.
- ^ (DE) F. Tiemann , A. Parrisius, About descendants of resorcinol, su Gallica, Berichte der Deutschen chemischen Gesellschaft zu Berlin - Reports of the German Chemical Society, 1880-07, pp. 2354-2381. URL consultato il 29 marzo 2021.
Voci correlate
|
|